
RAS突變驅動癌症
RAS 家族(KRAS/NRAS/HRAS)是人類腫瘤中最常見的致癌驅動基因之一,約 20%–30% 的實體瘤攜帶 RAS 突變。長期以來,RAS 被稱為「不可成藥」的靶點,但近 5 年來在結構生物學、藥物化學和組合策略上的突破,正在逐步改變這一局面。
作用機制
在正常細胞中,RAS 家族 GTPases(KRAS、NRAS 和 HRAS)在失活(與 GDP 結合)和激活(與 GTP 結合)之間循環。這種失活與激活受兩類因子的調節:
1)鳥嘌呤核苷酸交換因子(GEFs,如 SOS 蛋白),這類蛋白催化 KRAS 與 GTP 的結合,從而促進 KRAS 的激活;
2)GTP 酶激活蛋白(GTPase-activating proteins,GAPs),這類蛋白能夠促進與 KRAS 結合的 GTP 水解成為 GDP,從而抑制 KRAS 的激活。體細胞 KRAS 突變會減弱該蛋白的酶活性,導致 GTP 結合型、活躍的 KRAS 的積累,下游信號過度激活,從而導致失控的細胞增殖。
RAS 突變與腫瘤的關係:
RAS 是腫瘤中最常見的突變基因家族之一,約 1/3 的人類癌症中會發生 RAS 基因突變,因此 RAS 被稱為原癌基因。「熱點」位點(如 KRAS G12、G13、Q61)因不能有效水解 GTP 而持續激活,驅動細胞異常增殖與腫瘤發生。
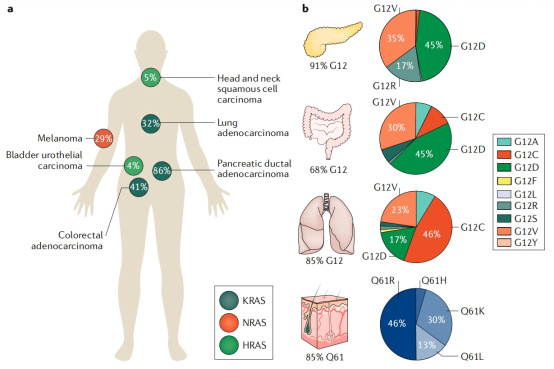
人類腫瘤中RAS突變的頻率跟分佈
藥物策略
RAS 突變是多種惡性腫瘤(如胰腺癌、肺癌、結直腸癌)的核心驅動因素,過去長期被視為「不可成藥」靶點,而近年的結構生物學與藥物化學進展讓直接或間接抑制 RAS 成為可能。
靶向 RAS 訊號通路的治療策略多種多樣,其中包括開發靶向突變 RAS 蛋白的直接抑制劑,既有 KRAS-off 抑制劑(這類抑制劑靶向失活狀態的 KRAS,抑制其向激活狀態轉變),也有 KRAS-on 抑制劑(這類抑制劑靶向激活狀態的 KRAS)。許多這些抑制劑正在臨床試驗中進行評估,概括下來,針對 RAS 的藥物策略主要有:
位點特異性共價抑制劑:針對具有可供共價結合殘基(如 G12C)的突變位點,設計不可逆抑制劑,鎖定 KRAS 於非活化構象,從而抑制下游訊號。
非共價選擇性抑制劑:針對 G12D 等突變開展結構導向的非共價抑制劑(可作用於活/非活狀態)。
上游/下游或輔助靶點聯用:例如 SOS1 抑制劑、SHOC2/MEK 聯合或 EGFR 聯合,用以抑制通路回饋與耐藥克服。
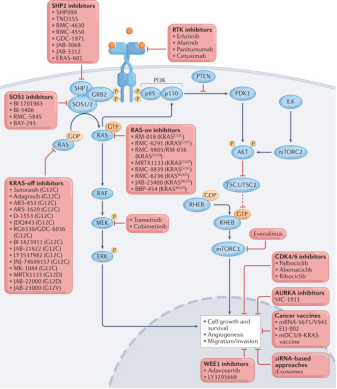
RAS訊號通路和針對癌症中該通路的治療方式
KRAS 為何難成藥?
KRAS 難成藥,主要的因素有三點:
1)RAS 蛋白對 GTP 皮摩爾級的親和力;
2)細胞內 GTP 濃度很高(~500 nM);
3)RAS 蛋白中缺乏深層的或藥理學上可操作的小分子結合口袋。
KRAS 蛋白 GTP 結合位點在特定 KRAS 突變體(如 G12C、G12D、G12V、G13D 和 Q61H 突變體)之間存在差異,這進一步複雜化了 KRAS 抑制劑的設計。因此,第一代 KRAS 直接抑制劑都與失活的、GDP 結合的突變 KRAS 結合(KRAS-off 抑制劑)。然而最近,KRAS-on 抑制劑(靶向活化的 GTP 結合的突變 KRAS)也已經被開發出來[3]。
KRAS 抑制劑耐藥機制
雖然 KRAS 不再是不可成藥的靶點,但 KRAS 抑制劑單藥治療的療效並不特別理想,且與其他單藥靶向治療一樣,腫瘤會對其產生耐藥性。
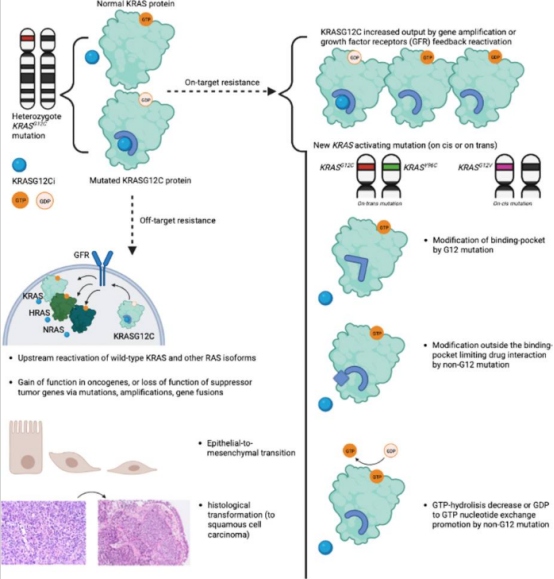
對OFF狀態KRASG12C抑制劑的「靶向」和「脫靶」耐藥機制總結
RAS 驅動型癌症的近期研究進展
KRAS 靶向治療快速進展:G12C 抑制劑 sotorasib、adagrasib(聯合抗 EGFR)已獲加速批准,非共價 G12D 抑制劑 MRTX1133 在胰臟癌模型展現顯著活性,SOS1 抑制劑 BI-3406 可與 KRAS 抑制劑協同延緩耐藥;耐藥機制包括二次突變、旁路激活及野生型 RAS 同族激活,正推動二代藥物與精準聯合策略研發。
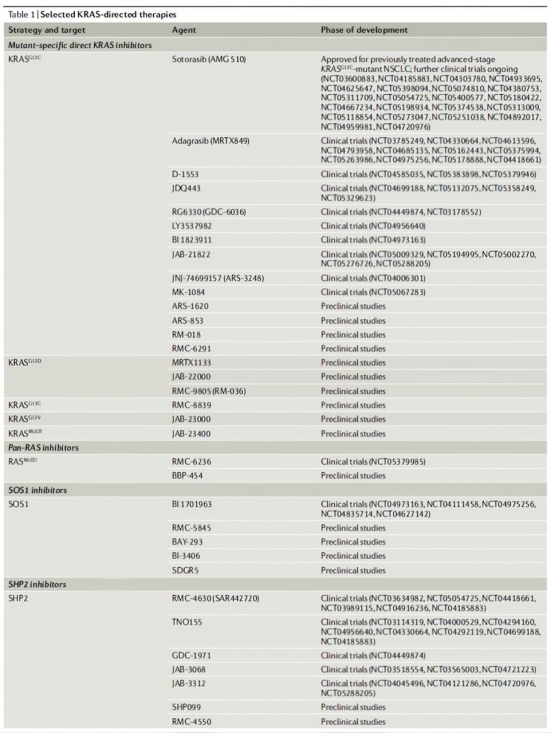
部分KRAS靶向療法
未來展望
RAS 已不再是「不能直攻」的堡壘——從 G12C 的臨床獲批到 G12D 的非共價抑制劑以及 SOS1 聯合策略,RAS 靶向治療正進入多靶點、組合化與精準分型的新階段。
未來,靶向 RAS 的治療有望以精密組合為常態,根據不同腫瘤類型的反饋和耐藥模式,將 KRAS 抑制劑與 SOS1、SHOC2、EGFR、MEK 或免疫治療等聯合以獲得更持久療效;同時,更精細的分子分型(突變亞型、共突變及免疫微環境特徵)將指導用藥與組合策略設計;此外,部分 KRAS 抑制劑(尤其針對 G12D 的藥物)在模型中可重塑免疫環境,激活腫瘤免疫浸潤,為小分子與免疫檢查點抑制劑的協同提供新方向。
TargetMol 熱門靶向 RAS 突變的抑制劑
目前,TargetMol 可提供超過 170 種 RAS 家族不同突變體的多種直接或者間接抑制劑,廣泛用於揭示信號通路機制、篩選和優化新藥,以及驗證聯合治療策略和推動臨床轉化的全鏈條癌症研究。
| 產品編號 | 產品名稱 | 靶點 | 產品連結 |
| T72062 | BI-2865 | pan-KRAS | https://www.targetmol.com/compound/bi-2865 |
| T8684 | Sotorasib | KRAS G12C | https://www.targetmol.com/compound/amg-510 |
| T8369 | Adagrasib | KRAS G12C | https://www.targetmol.com/compound/adagrasib |
| T7414 | ARS-853 | KRAS G12C | https://www.targetmol.com/compound/ars-853 |
| T7609 | ARS-1620 | KRAS G12C | https://www.targetmol.com/compound/ars-1620 |
| T40292 | Opnurasib | KRAS G12C | https://www.targetmol.com/compound/jdq-443 |
| T9972 | Divarasib | KRAS G12C | https://www.targetmol.com/compound/gdc_6036 |
| T36256 | LC-2 | KRAS G12C; PROTACs | https://www.targetmol.com/compound/lc-2 |
| T9303 | MRTX1133 | KRAS G12D | https://www.targetmol.com/compound/mrtx1133 |
| TP2358 | KRPEP-2D acetate | KRAS G12D | https://www.targetmol.com/compound/krpep-2d%20acetate |
| T74698 | RMC 6236 | WT KRAS、HRAS 和 NRAS 亞型 | https://www.targetmol.com/compound/ras-in-2 |
| T78212 | RMC9805 | KRAS G12D | https://www.targetmol.com/compound/kras_g12d_inhibitor_18 |
| T81263 | RMC-7977 | KRAS (G12V)、NRAS 、HRAS | https://www.targetmol.com/compound/rmc_7977 |
| T38170 | RMC-0331 | SOS1 | https://www.targetmol.com/compound/rmc-0331 |
| T12979 | BI-3406 | SOS1 | https://www.targetmol.com/compound/bi-3406 |
參考文獻
[1]Moore AR,et,al. RAS-targeted therapies: is the undruggable drugged? Nat Rev Drug Discov. 2020 Aug;19(8):533-552.
[2]Punekar SR,et,al. The current state of the art and future trends in RAS-targeted cancer therapies. Nat Rev Clin Oncol. 2022 Oct;19(10):637-655.
[3]Ostrem JM, et,al. K-Ras(G12C) inhibitors allosterically control GTP affinity and effector interactions. Nature. 2013 Nov 28;503(7477):548-51.
[4]Chour A, et,al. Mechanisms of resistance to KRASG12C inhibitors in KRASG12C-mutated non-small cell lung cancer. Front Oncol. 2024 Sep 5;14:1328728.





